| 编 码 The coding | XJJ-2008-0010 |
| 葡萄牙文名称 Nome em portugues | peróxido de hidrogênio |
| 其他名称 Other names | 过氧化氢;双氧水(不同浓度的过氧化氢水溶液);二氧烷。hydrogen peroxide (CIPAC);Adeka Super EL;Albone;Albone 35;Albone DS;Anti-Keim 50;Arion Cronos;Asepticper;B 296644;B-Cap 35;B-Cap 50;Baquashock;CIX;Clarigel Gold;Corega Extradent;Crest whitestrips;Crestal Whitestrips;Crystacide;Day White;Dentasept;Deslime LP;Dezinbak Super;Diapower HP;Dioxy 100L;EcoClearProx;FQ 301;Hioxyl;Hipox;Hybrite;Hydrogen dioxide;Hyprox 350;Inhibine;Interox Paramove 50;Interox ST 50;Interox ST 60;Lase Peroxide;Lensan A;M 70;Magic Bleaching;Metrokur;Mirasept;Neoseptal D;Nite White Excel 2;NSC 19892;Odosat D;Opalescence BOOST;Opalescence Boost PF;Opalescence Xtra;Opalescence Xtra Boost;OX-AGUA AL25;OxiDate;Oxidol;Oxigenal;Oxydol;Oxyfull;Oxysept;Oxysept Comfort;Oxysept I;Pegasyl;Perhidrol;Perhydrol;Perone;Peroxaan;Peroxal 50;Peroxclean;Peroxy-Blend PB 31;Peroxy-Blend PB 33;Poladay;Quasar Brite;Select Bleach;Superoxol;T-Stuff;TerraClean;UELM 35;Virox;Whiteness HP;Whiteness HP Maxx;Whiteness HP/FGM;Whitespeed;Xtra White;Zerosil;ZOOM 2. |
| 中文化学名称 Chinese chemical names | 过氧化氢 |
| 英文化学名称 Chemical names(IUPAC or CAS) | Hydrogen peroxide |
| IUPAC国际化学品标识符 (InChi) V. 1.06 | InChI=1S/H2O2/c1-2/h1-2H |
| IUPAC国际化学品标识搜索码 (InChi Key) V. 1.06 | MHAJPDPJQMAIIY-UHFFFAOYSA-N |
| 二维化学结构式 2D Chemical structure | |
| 三维化学结构式或晶体结构或图像 3D Chemical structure or crystal structure or the image | |
| 分子式或实验式 Formul | H2 O2 |
| 相对分子质量 RMM | 43.015 |
| 精确相对分子质量 Exact mass | 34.005478 |
| 元素分析 Elemental analysis(计算值 Calcd.,%) | H, 5.93; O, 94.07 |
| 化学结构类别(基团)或来源 Chemical classes(Groups) or source | 无机化合物/过氧化物 |
| 化学文摘社登录号 CAS registry number | 7722-84-1 |
| 欧盟化学品管理局编号 ECHA number | 231-765-0 |
| 国际农药分析协作委员会编码 CIPAC code numbers | 755 |
| 中国海关商品编码 Chinese Customs commodity code numbers(2022) | 2847000000 |
| 简 介 Introduction | 过氧化氢是易制爆的强氧化剂。通常以水溶液的形式在市场上获得,并根据其浓度受到不同法规的管制。主要商品为含过氧化氢30%、50%、70%或90%的水溶液,及抑制其分解的稳定剂。它与许多化合物化合而形成结晶体,可用作温和氧化剂,其中最著名的是过硼酸钠(NaBO2·H2O2·3H2O或NaBO3·4H2O)。它与某些有机化合物反应可形成氢过氧化物或过氧化物,其中有几种能用于触发聚合反应。它虽可被少数几种化合物如高锰酸钾氧化,但在大多数反应中是它氧化其他物质。 |
| 理化性质 Physical & chemical properties | 纯品为极浅蓝色,几乎无嗅的苦味粘稠液体。熔点 -0.43 ℃,沸点 150.2 ℃(分解或爆炸),蒸气压 0.19 kPa (20 ℃),折射率 n20D 1.408 4,黏度 1.249 mPa·s (20 ℃),辛醇/水分配系数 Kow logP -0.43,相对密度 1.450 0 (20 ℃),闪点 107 ℃,解离常数 pKa 11.65,水溶液呈弱酸性。溶解度:与水混溶。可溶于乙醚和乙醇,不溶于苯和石油醚。 稳定性:能与铜、黄铜和碘化钾发生剧烈反应。特别在高浓度溶液和与金属表面接触或存在金属盐和氧化物的情况下,对光、热敏感。加热如达153 ℃时便发生猛烈的热分解为水和氧气,密闭易爆,造成严重事故。不可燃但助燃。具腐蚀性。 |
| 原药和制剂 Technical and Preparations |  制剂:1. 15~30 克(a.i.)/升消毒液;2. 10~15,25~49克(a.i.)/升种子处理液剂。通常使用浓度<5 %。制剂中含有磷酸、磷酸盐或N-乙酰苯胺和N-乙酰乙氧基苯胺稳定剂。 制剂:1. 15~30 克(a.i.)/升消毒液;2. 10~15,25~49克(a.i.)/升种子处理液剂。通常使用浓度<5 %。制剂中含有磷酸、磷酸盐或N-乙酰苯胺和N-乙酰乙氧基苯胺稳定剂。 |
| 用 途 Use type | 杀细菌剂、杀菌剂 |
| 非农药用途 Other uses | 医药,兽药消毒防腐药、食品添加剂/加工助剂、化学试剂/有机合成、漂白剂/棉织品,木质纸浆,牙齿美白、原料/实验室制氧、小型火箭推进剂 |
| 主要防治对象和施用方法 Main targets & applications | 1. 预防番茄和甜椒的土传细菌病害,如青枯雷尔氏菌(Ralstonia solanacearum)引起的青枯病、灰葡萄孢菌(Botrytis cinerea)引起的灰霉病。作业用剪刀等,每次用前须在药液清洗后等待30秒再操作。2. 防治由油菜黄单胞菌莴苣致病变种(Xanthomonas campestris pv. vitians)引起的莴苣细菌性叶斑病。防治真菌病害,像常见的百日菊,由百日菊链格孢菌(Alternaria zinniae)、互隔交链孢(Alternaria alternata)和镰刀菌(Fusarium Spp.)引起的百日菊黑斑病。播种前将种子浸入制备好的药液中5~15 min后取出。 |
| 危害象形图 Hazard pictogram | |
| 毒理和归宿 Toxicology & Fate | 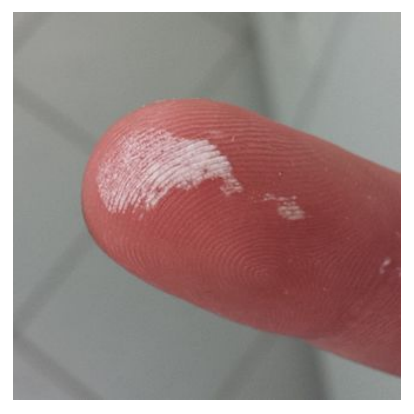
急性毒性:经口半数致死量LD50 雌大鼠
693.7 mg/kg (OECD测试导则401)。大鼠经皮LD50 >2
000 mg/kg(US-EPA)。对人的眼睛和皮肤有强烈刺激作用,会造成严重眼损伤和皮肤严重灼伤。含量超过8
%的水溶液对皮肤就有腐蚀作用。如果皮肤接触了过氧化氢,应该用水反复冲洗干净。如果它穿透皮肤,会在那里迅速分解,产生的氧气气泡使皮肤看起来很白(见图)。一般来说,过氧化氢具有细胞毒性作用,正是这样的强毒性,才能作为许多原核微生物的消毒剂。过氧化氢在许多生化过程中产生。在生物循环中,它是由糖的氧化代谢产生的。生物体通过过氧化氢酶,过氧化物酶保护自身免受中毒。过氧化氢酶是一种能催化过氧化氢分解为水及氧的反应酶,广泛存于哺乳动物的组织内。许多代谢反应过程中连续不断地产生过氧化氢,过氧化氢酶能防止过氧化氢积聚,从而保护机体组织免受其害。有人因缺乏过氧化氢酶而引起的一种罕见的遗传性疾病称过氧化氢酶缺乏症。虽然患者机体的许多组织(包括红细胞、骨髓、肝脏及皮肤)都能发现过氧化氢酶缺乏,但只有约半数患者出现症状。表现为牙龈和口腔其他组织反复感染,并可导致坏疽。这种损害在青春期后极为少见。本病在日本和朝鲜人中常见报道。在日本发病率估计为十万分之二。
极力避免:误饮或以双氧水灌肠,可能使口腔或消化道的黏膜受侵蚀而导致发炎,严重时可能穿孔或出血。注射双氧水,将导致血栓,容易导致器官坏死,严重者可能会有生命危险。过氧化氢疗法的有效性和安全性在科学上都是值得怀疑的。不要轻信,没有科学证据表明过氧化氢是一种安全,有效或有用的癌症治疗方法。
爆炸等事件:已公开报道的有:1.
1934年7月16日,在德国库默斯多夫,一个装有由过氧化氢和乙醇组成的推进剂混合物在一次试验中爆炸,造成3人死亡。2.
1939~1945年,第二次世界大战期间,纳粹德国在集中营中使用过氧化氢作为对人致死的试验品。3.
1992年4月,法国Jarrie的过氧化氢厂发生爆炸,原因是计算机控制系统的技术故障,导致1人死亡,工厂遭到大规模破坏。4.
1998年10月28日,美国奥兰多市和孟菲斯市之间的一架航班上发生过氧化氢泄漏事件,造成数人轻伤。5.
2000年8月12日,俄罗斯库尔斯克号核潜艇鱼雷舱中的鱼雷在发射时由于内部过氧化氢燃料与催化剂接触,剧烈反应,导致爆炸,继而引起连锁反应,引爆了鱼雷舱中的所有鱼雷,彻底炸毁潜艇的前部,令潜艇最终沉没。全艇118人无人生还。6.
2010年8月15日,纽约市时代广场百老汇1515号54楼发生约110升过氧化氢清洁液泄漏。7.
2023年5月1日,鲁西化工双氧水生产区爆炸火灾事故,造成9死1伤1失联。事故原因初步分析为双氧水装置工作液配置釜用于回收工作液时,吸入大量70 %双氧水,釜内可能存在杂质造成双氧水剧烈分解,引发配置釜超压爆炸。
生理作用:有研究指出,老年头发灰白,是头发中过氧化氢被降解较少的结果。过氧化氢对酪氨酸酶中所含氨基酸蛋氨酸的氧化,会影响黑色素产生所需的酪氨酸酶的活性。据报道过氧化氢是诱导植物防御病原体(细胞毒性方面)的信号分子。
生态毒性:对水生生物有害并具有长期持续影响。
环境存在:研究发现水系无机物、有机物在氧化时,或者在生物体内呼吸氧气时,生成水之前一般会生成过氧化氢。过氧化氢无处不在,存在于地表水、地下水和大气中,以及生物体内。它是在光照或水中所含物质的自然催化作用下形成平衡。海水含有0.5~14 μg/L过氧化氢,淡水含有1~30
μg/L,空气中的浓度约为0.4~4 μg/m3,根据季节、海拔、日光和水蒸气含量等条件而会有几个数量级的变化。在农村夜间空气中,低于0.014 μg/m3,在中度光化学烟雾中的浓度为14~42 μg/m3。
|
| 国际癌症研究机构致癌性分类 Agents Classified by the IARC Monographs | 3(现有证据不足以分类)。详见IARC MONOGRAPHS-36、IARC MONOGRAPHS-71。 |
| 沿 革 History | 1818年,法国化学家路易·雅克·泰纳尔(Louis Jacques Thénard) 首次确认由过氧化钡与硝酸反应产生的是一种未知的化合物,他将其描述为eau oxygénée(“含氧水”) — 后来其被称为过氧化氢。该工艺后来通过使用盐酸进行改进,然后是硫酸。后者特别合适,因为副产物硫酸钡沉淀。泰纳尔的生产方法从19世纪末到20世纪中叶一直使用。无水超纯过氧化氢最早是由理查德·沃尔夫芬斯坦(Richard Wolffenstein)于1894年通过减压蒸馏获得。第一座生产过氧化氢的工厂于1873年在柏林建成。1939年巴斯夫开发生产过氧化氢的蒽醌工艺。 |
| 出版(发布)机构与版本 Published agencies & versions | 国际农药分析协作委员会 CIPAC |
| 登记状态 Status | 中国未登记。美国登记。欧盟批准 |
| 备注 Remarks | 2023年5月20日第2次修订 |