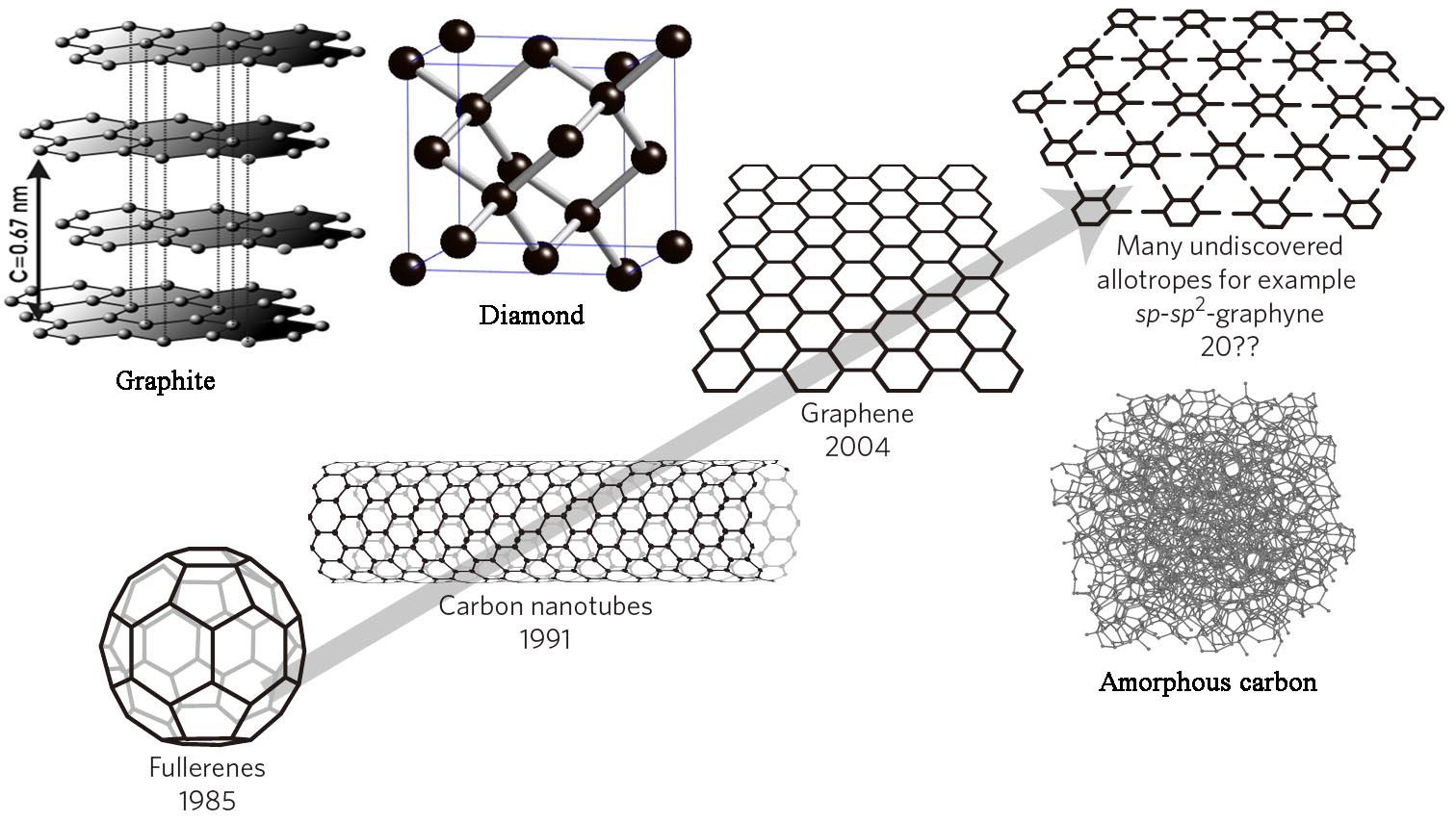
 同素异形体 Allotrope,由于构成物质的原子的排列不同,或原子之间的成键、排列方式不同,使得同一种元素产生多种单质。由同一种元素组成的物理性质不同的单质叫做同素异形体。同素异形体之间的性质差异主要表现在物理性质上,化学性质上也有着活性的差异。例如磷的两种同素异形体,红磷和白磷,它们的着火点分别是240 ℃和40 ℃,充分燃烧之后的产物都是五氧化二磷;白磷(P4)有剧毒,可溶于二硫化碳,红磷(Pn)无毒,却不溶于二硫化碳。同素异形体之间在一定条件下可以相互转化,这种转化是一种化学变化。磷的固体同素异形体,当熔化成液态时,它们都恢复到相同的P4形式。碳的同素异形体包括金刚石(碳原子以四面体晶格排列结合在一起),石墨(碳原子以六方晶格的片结合在一起),石墨烯(单片石墨)和富勒烯(碳原子以球形,管状或椭圆形结合在一起)。术语同素异形仅用于元素,不用于化合物。同素异形体的先决条件是该元素应有至少2种以上单质。
同素异形体 Allotrope,由于构成物质的原子的排列不同,或原子之间的成键、排列方式不同,使得同一种元素产生多种单质。由同一种元素组成的物理性质不同的单质叫做同素异形体。同素异形体之间的性质差异主要表现在物理性质上,化学性质上也有着活性的差异。例如磷的两种同素异形体,红磷和白磷,它们的着火点分别是240 ℃和40 ℃,充分燃烧之后的产物都是五氧化二磷;白磷(P4)有剧毒,可溶于二硫化碳,红磷(Pn)无毒,却不溶于二硫化碳。同素异形体之间在一定条件下可以相互转化,这种转化是一种化学变化。磷的固体同素异形体,当熔化成液态时,它们都恢复到相同的P4形式。碳的同素异形体包括金刚石(碳原子以四面体晶格排列结合在一起),石墨(碳原子以六方晶格的片结合在一起),石墨烯(单片石墨)和富勒烯(碳原子以球形,管状或椭圆形结合在一起)。术语同素异形仅用于元素,不用于化合物。同素异形体的先决条件是该元素应有至少2种以上单质。
同素异形的概念最初由瑞典科学家Baron Jöns Jakob Berzelius(1779~1848)于1841年提出。通常,具有可变配位数和/或氧化态的元素倾向于表现出更多数量的同素异形体。常见具有同素异形体的金属元素有锗Ge (α-锗、β-锗)、锑Sb (金属锑、黄锑、黑锑、无定形锑)、锡Sn (α-锡(灰锡)、β-锡(白锡)、γ-锡(斜方锡)、铁Fe (α-铁(肥粒铁)、β-铁、γ-铁(奥氏体)、ε-铁、δ-铁);非金属元素有碳C (钻石、石墨、蓝丝黛尔石、无定形碳、碳纳米管、碳60富勒烯)、磷P (白磷(黄磷)、红磷(赤磷)、黑磷、紫磷)、氧O (氧气(O2)、臭氧(O3)、氧4(四聚氧)(O4)、氧8(红氧)(O8)、金属氧)、硫S (斜方硫(S8)、单斜硫(S8)、弹性硫)、硒Se (灰硒、红硒、黑硒)、硅Si (晶体硅、无定形硅)、砷As (黄砷、灰砷、黑砷)、氢H (氢气(H2)、氢3(H3)、金属氢)、硼B (无定形硼、α-菱形硼、β-菱形硼、γ-正交硼、α-四方硼、β-四方硼)、碲Te (无定形碲、晶体碲)。镧系元素和锕系元素也有同素异形体。