 吡啶(Pyridine)从化学分子结构上看,亦可称一嗪,是一个氮
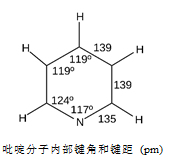
吡啶(Pyridine)从化学分子结构上看,亦可称一嗪,是一个氮 原子取代了苯环上的一个碳原子而形成的化合物,是苯的等电子体。分子式C5 H5 N,相对分子质量79.10,CAS登录号110-86-1。吡啶中氮原子的5个电子,1个用来与其它碳原子形成大π键,因此吡啶仍有芳香性。又因为氮原子负的诱导效应,吡啶π电子云分布不均匀,其共振能小于苯(吡啶为117 kJ·mol-1,苯为150 kJ·mol-1)。氮的诱导效应还反映在C-N键长(135 pm)小于苯环中C-C键长,吡啶环中C-C键长与苯环相同(139 pm)。吡啶中氮的邻、间或对位碳原子再被氮取代生成化学式为C4 H4 N2的化合物依次为哒嗪、嘧啶和吡嗪。
原子取代了苯环上的一个碳原子而形成的化合物,是苯的等电子体。分子式C5 H5 N,相对分子质量79.10,CAS登录号110-86-1。吡啶中氮原子的5个电子,1个用来与其它碳原子形成大π键,因此吡啶仍有芳香性。又因为氮原子负的诱导效应,吡啶π电子云分布不均匀,其共振能小于苯(吡啶为117 kJ·mol-1,苯为150 kJ·mol-1)。氮的诱导效应还反映在C-N键长(135 pm)小于苯环中C-C键长,吡啶环中C-C键长与苯环相同(139 pm)。吡啶中氮的邻、间或对位碳原子再被氮取代生成化学式为C4 H4 N2的化合物依次为哒嗪、嘧啶和吡嗪。
 吡啶由苏格兰化学家托马斯·安德森于1849年在骨焦油中发现,两年后,安德森通过分馏得到纯品。由于其易燃,安德森以希腊语:πῦρ (τὸ)(pyr,意为火)命名。吡啶的结构由Wilhelm Körner(于1869年)和詹姆斯·杜瓦(于1871年)独立确定。
吡啶由苏格兰化学家托马斯·安德森于1849年在骨焦油中发现,两年后,安德森通过分馏得到纯品。由于其易燃,安德森以希腊语:πῦρ (τὸ)(pyr,意为火)命名。吡啶的结构由Wilhelm Körner(于1869年)和詹姆斯·杜瓦(于1871年)独立确定。
常温下,吡啶是一种无色液体,有强烈的不愉快气味,熔点 -41.6 ℃,沸点 115.2 ℃,,蒸气压 2.133
kPa (20 ℃),辛醇/水分配系数 Kow logP 0.73,相对密度0.981 9,闪点 21 ℃,爆炸极限
1.8~12.4 %。可以与水、乙醚和乙醇等任意比例混合。其本身也可作溶剂,可以溶解各种有极性或无极性的化合物,甚至是无机盐。其溶解性与其他有机化合物有所不同的是:吡啶环上被取代的羟基越多,其在水中的溶解度反而下降。
吡啶是典型的杂环芳香化合物。由于在吡啶环中的氮的电负性大,与苯环相比缺电子,故难发生亲电取代反应,其亲电取代反应在3-或5-位进行,与硝基苯类似。相反地,吡啶能与强碱发生亲核取代反应,例如齐齐巴宾反应。
吡啶能催化加氢,兰尼镍催化生成六氢吡啶(哌啶)。反应热为-193.8 kJ·mol-1,释放热量略小于苯催化加氢(205.3 kJ·mol-1)。它也可以被钠与乙醇还原为六氢吡啶。
 由于氮上的孤对电子,具有叔胺的性质,吡啶具有碱性,也是一种良好的配体。其共轭酸吡啶合氢离子的pKa 5.30。吡啶能与活泼卤代烃形成季铵盐;被过氧化物氧化,形成N-氧化物。
由于氮上的孤对电子,具有叔胺的性质,吡啶具有碱性,也是一种良好的配体。其共轭酸吡啶合氢离子的pKa 5.30。吡啶能与活泼卤代烃形成季铵盐;被过氧化物氧化,形成N-氧化物。
吡啶能发生一系列的自由基反应而二聚。使用不同引发剂反应具有选择性。如用钠得到4,4'-联吡啶,兰尼镍得2,2'-联吡啶,后者是化学工业中重要前体的试剂。4,4'-联吡啶是在中国已禁用的灭生性除草剂百草枯的前体。
吡啶可从天然煤焦油中获得,但煤焦油中只含约0.1 %的吡啶,需通过多级分馏,故效率低下。目前吡啶主要通过各种途径化学合成,例如乙醛和氨通过齐齐巴宾吡啶合成;醛、β-酮酯和和含氮化合物之间的汉奇吡啶合成。
齐齐巴宾合成首次发表于1924年,该方法至今仍用于吡啶的工业生产。反应需要高温(400~450 ℃),以及过渡金属催化剂。
吡啶除作溶剂外,吡啶在工业上还可用作变性剂、助染剂,以及合成一系列产品的起始物,包括农药、药品、消毒剂、染料、食品调味料、粘合剂、炸药等。
吡啶有毒,通过吸入、摄取或皮肤接触进入体内。急性中毒的影响包括头晕、头痛、缺乏协调、恶心、流涎、食欲不振,可能发展成腹痛、肺淤血、神志不清。人体的最低致死量(LDLO)为500 mg/kg。经口大鼠半数致死量 LD50 891 mg/kg。高剂量的吡啶具有麻醉作用,其蒸气浓度超过3 600 mg/L将对健康构成威胁。吡啶也可能有轻微的神经毒性,遗传毒性和诱导染色体断裂的影响。
引自维基百科等 (2021-05-25)